膜片钳实验简介- 膜片钳的基本原理及记录方法
电生理学是研究电兴奋细胞及其网络功能和功能障碍的重要工具。膜片钳是一种精细的电生理技术,可以直接测量膜电位和/或通过细胞膜的电流量。膜片钳技术也具有难以置信的多功能性,可用于多种不同的结构,以研究一系列特性,从天然组织中的自发细胞放电活动到重组细胞系中表达的单个通道的激活和/或失活动力学。本文中,我们概述了膜片钳技术以及如何建立不同的膜片钳记录方法并将其应用于电生理研究。
简介
电生理学是研究电兴奋细胞(通常是神经元)及其网络,以及越来越多的非兴奋细胞的功能和功能障碍的重要工具。正确应用电生理技术需要了解细胞的物理和化学特性,以及这些特性如何影响离子在细胞膜上的传输。20 世纪 50 年代早期, Alan Hodgkin 和 Andrew Huxley 的关键电生理实验首次完整描述了动作电位的离子机制,他们使用粗糙的玻璃电极测量了鱿鱼巨大轴突的膜电位1。这一进展于 1963 年获得诺贝尔生理学和医学奖。进一步的发展包括使用非常精细的玻璃电极刺穿细胞膜并进行细胞内膜电位变化的记录。然而,这些“锋利”的电极在很大程度上不适合记录离子通道的活动,因为电极必须同时测量膜电位和瞬时注入电流。 Bert Sakmann 和 Erwin Neher 克服了这个问题,他们使用相对大口径的电极与细胞表面形成紧密的封接,而不是穿透细胞膜。这种方法最初被称为“细胞外膜片钳”,这种方法测量到了单个或数个离子通道上的电流2,3。 Sakmann 和 Neher 于 1991 年获得诺贝尔生理学和医学奖。该方法已被进一步发展为多种不同的记录方法,可以高分辨率研究细胞膜中的全细胞离子通道电流、细胞贴附或分离的膜片中的单个离子通道电流,如下文所述。
细胞膜及其电特性
细胞膜严格控制细胞外液和细胞内液的渗透压,这使得钠(Na+)、钾(K+)、氯(Cl-)以及钙(Ca2+)等特定离子的浓度梯度产生很大差异。细胞膜本质上是两种导电溶液之间的一层薄薄的绝缘层,它将这些离子的不均匀分布分开,并使细胞内和细胞外溶液的电荷产生差异。由能斯特方程测得的单个离子的平衡电位,在细胞膜上产生一个电势,并以电压的形式测得,因此细胞内部比外部电势低得多。由于细胞膜可以分离和储存电荷,因此它在电气上就像一个电容器,充电和放电需要时间,因此可以减缓膜电位的变化。
尽管细胞膜对带电粒子是不可渗透的,但离子还是有可能通过专门的离子通道和转运体穿过细胞膜。由于电压门控离子通道的构象变化而产生的电荷运动允许离子流动,这种运动形成了神经元电活动的基础,并被测量为电流。电流的大小和流量由驱动力(电压)和阻碍离子通过细胞膜的阻力(电阻)决定。因此,通过细胞膜(相当于一个电阻)的电流( I )与通过它的电势( V )成正比,根据欧姆定律与电阻( R )成反比:
通过细胞膜的电位和电流可通过多种直接(细胞内)或间接(细胞外)电生理方法测量4;在这里,我们重点介绍膜片钳技术作为主要的细胞内方法。
膜片钳记录的方法
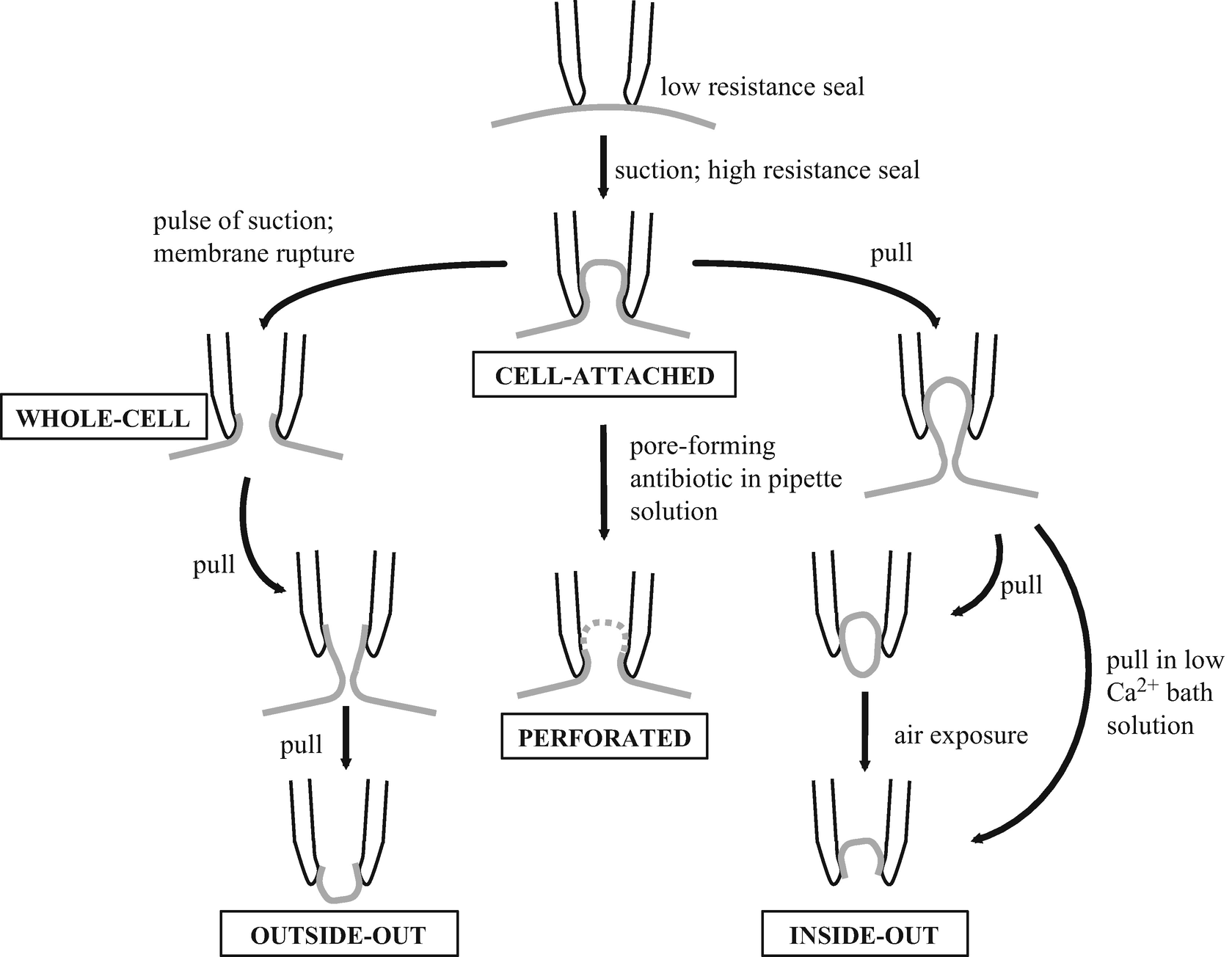
膜片钳法是一种电生理技术,它使用一个相对大孔径的玻璃电极在细胞表面形成紧密的密封,并记录细胞膜上离子通道的活动2,3。这种方法可用于直接测量在固定电压下通过细胞膜的电流量,也被称为电压钳。或者,可以在电流钳制模式下测量在固定电流下细胞膜的两侧的电压值变化。在膜片钳发展之前,测量细胞膜电位的传统方法是使用尖细微电极技术(细胞内测量);这种方法使用高电阻玻璃电极,电极尖端直径很小,可以穿透细胞膜。尖细微电极技术的一个主要缺点是细胞膜的渗透和损伤在微电极周围导致了一个显著的漏电流,需要注入额外的电流来补偿这个漏电流;另一个缺点是不能充分补偿微电极的电容。膜片钳不仅被认为是尖细微电极技术的一种改进,而且它的用途更广,特别是由于它能够适应各种不同的测量方式5(见图1)。不同的膜片钳结构有助于研究细胞膜中的所有离子通道(全细胞模式)以及单个离子通道,无论是在完整的细胞膜(细胞附着模式)还是在分离的膜片中(“外面向外”和“内面向外”测量方法)。正如本文其他地方所讨论的,膜片钳方法已经被用于更高吞吐量的自动化(通常是全细胞)记录。本章将重点介绍手动膜片钳技术,通常用于确认和扩展自动膜片钳数据,并将强调其在体细胞、树突状细胞和突触前区室以及内部细胞器膜记录方面的多功能性。我们也将思考膜片钳技术是如何被用来推进电生理和其他生理功能的研究。
膜片钳记录中的电力学原理及注意事项
当含有导电溶液的电极与浴液接触时,电流会流过电极尖端并直接流向记录仓中的接地电极。此时电极的电阻( Rp )可以根据欧姆定律通过测量响应放大器控制电压阶跃的电流来计算。每个膜片钳实验基本上都从细胞贴附模式开始的(见图 1),这时的电极与细胞膜紧密接触以形成密封。欧姆定律也可以在封接形成的过程中应用,因为电极尖端与细胞膜贴近导致离子流动显著减少,这表现为电流显著减少,理想情况下会形成电阻高达“千兆欧”( >1GΩ )的封接。
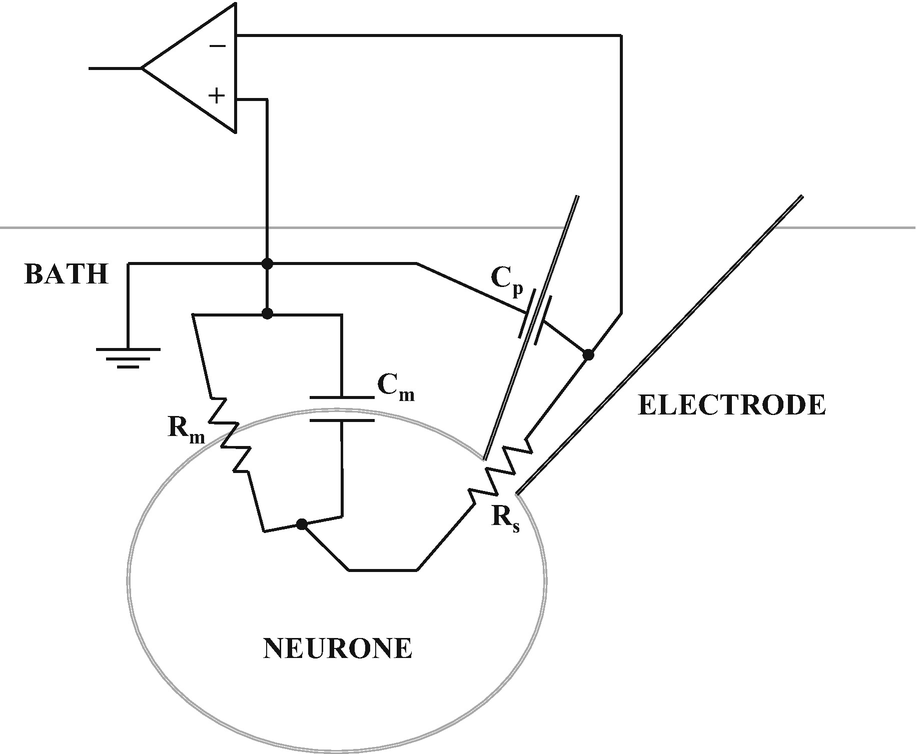
电极的玻璃壁是电极内外溶液之间的绝缘体,因此会引入电极电容( Cp )的概念,当建立千兆欧姆密封时,会在测试脉冲的开始和结束时产生快速电流瞬变。这些快速电流瞬变可以使用电阻式探头通过注入电流来补偿(快电容补偿),其波形抵消了 Cp 的影响,直到测试脉冲理想地类似于一条直线(即没有电流瞬变)。一旦建立了细胞贴附模式并补偿了快速瞬变,膜片钳实验员就可以尝试“击破”细胞膜形成全细胞记录模式。至于测试脉冲,由于在形成全细胞记录模式时,细胞磷脂膜会形成膜电容( Cm ),因此会出现一个相对缓慢的电流瞬变。 Cm 的补偿方式与 Cp 类似(慢电容补偿)。全细胞记录模式的形成也会在玻璃电极壁和细胞磷脂膜之间引入串联电阻 ( Rs )的概念; Rs 代表电极电阻( Rp )和电极与细胞内部各种阻抗的( Ra )的总和。因此还需要对 Rs 进行补偿,以最大程度地减少实验期间的电压和时间误差。进行各种补偿之后,就可以准确地测量从电极流出、进入细胞并穿过细胞膜到达接地电极的所有电流。图 2是全细胞记录模式的等效电路示意图。
在膜片钳记录的所有模式中,模拟信号由带有内置数字化仪或放大器的膜片钳放大器与单独的数字数据设备相结合来数字化。信号以特定频率(通常为 5-20KHz)采集或采样,较高的采样率用于更快开启和关闭的离子电流,例如失活的瞬时Na+电流,或用于快速波形(例如神经动作电位)。信号通常以大约五分之一到三分之一的采样率进行低通滤波,以降低固有的电气系统噪声。
电压钳
通过使用细胞内记录技术,可以通过膜电位的变化来测量离子通道的活性,膜电位反映了膜对进入或离开细胞的特定离子的渗透性。然而,然而细胞内记录技术难以对离子通道行为进行研究,因为膜电位的变化与某些离子通道的门控机制相耦合。因此,需要将膜电位固定(“钳制”)在恒定值,并直接记录通过细胞膜的电流。这可以通过电压钳来实现,电压钳是一种使用反馈电路将膜电位设置为所需值的技术。电压钳通过注入与流经细胞膜离子通道的电流相反且相等的电流来工作。保持膜电位恒定所需的电流量可直接测量流过膜的电流。不同的电导可以通过特定的“阶跃” protocol 激活,其中在适当的持续时间内施加电压增量,或者通过电压“斜坡” protocol 激活,从而在适当的范围内施加持续增加的电压脉冲( P )以激活感兴趣的电导。作为电流激活 protocol 的一部分,由于欧姆响应而产生的“泄漏”电流,可以通过在电压脉冲( P )的固定整数次( N )施加 1/N 强度(要保证此强度下你想要测量的离子通道还未激活)的电压脉冲( P1/N )激活 1/N 强度的“泄漏”电流,正常( P )下测得的电流减去 N 倍( P1/N )下测量的电流即可将该污染泄漏电流减去。电压钳通常用于在整个细胞或单通道水平上记录通过电压门控或配体门控离子通道的电流运动,或记录由于作用于离子受体的神经递质而产生的突触后电流。离子通过电动转运蛋白的运动也可以在这种模式下测量。
电流钳
如果膜电位未被钳制,而是注入了固定量的电流,则可以使用电流钳制模式测量通过串联的电极和细胞膜之间的电压变化。通过直流(DC)注入,细胞通常被钳制在接近其静止膜电位的位置。电流钳中的 Rs 可以很容易地估计,并使用“电桥平衡”电路进行调整,以补偿电压误差。产生放电活动所需的最小电流被称为“rheobase”,是衡量兴奋性和封接/记录质量的有用指标。在记录过程中,可以使用小电流注入(保持电流约 10–20pA)监测输入电阻等测量值。电流钳模式可用于监测静息膜电位,其可提供关于修补细胞健康的有用信息,电流钳通常用于记录电兴奋性单个细胞(如神经元)中的再生细胞放电或突触电位,或者应用在神经网络中,特别是在离体脑切片中。
膜片钳记录模式
细胞贴附模式
在电极进入槽液之前施加一个小的振荡测试脉冲(例如,5mV,5ms),然后当电极下降到槽液中时,就可以测量到电极电阻 Rs (直径为 1–3μM的电极,电极电阻通常为 2–7MΩ)。向电极内部施加正压可使电极尖端排出非常小体积的溶液;当靠近细胞时,这通常会导致细胞膜上出现轻微的“酒窝”凹痕,这也可以有效地“清洁”目标细胞的表面,这在试图钳制急性分离组织切片中的细胞时通常是必不可少的步骤6。释放电极内的正压,使靶细胞和电极之间的直接接触,此时通常需要施加少量吸力;在这个阶段,电极可以说是“在细胞上”,并且可以从完整膜片中的离子通道记录活性。“松散”封接(MΩ级而非GΩ级)可用于监测电池放电活动;这种模式的优点是,例如,可以在双电极双通路记录中搜索活动的突触前输入时,电极也可以重复使用。与松散封接技术中,大电极(或“巨大”电极)可用于隔离较大面积的膜;此模式可用于记录具有低通道密度的离子通道或转运体,并可用于记录不适于紧密封接的大细胞,例如非洲爪蟾卵母细胞或植物细胞。巨钳制记录需要使用电阻较低的电极(通常<2MΩ),其尖端直径相对较大(10μM),并且不可避免地有较大的泄漏电流和较高的噪声。然而,更常见的是继续进行“紧密”封接模式,以促进良好的电压或电流控制。因此,向电极内施加负压以快速增加 并形成高电阻密封(即>1GΩ),通过使膜向静息膜电位超极化可促进该记录模式形成。与 (通常<10pF)相关的快速电流瞬变会消失。现在可以执行细胞贴附模式的记录或推进到其他模式,例如内面向外模式、全细胞记录模式、穿孔式全细胞记录或外面向外模式(如下所述)。
紧密封接的细胞贴附模式通常用于测量自发细胞放电,但也可用于记录单通道电流或此类电流的总活动。在这种模式下,细胞内成分不会被“洗掉”,可以将试剂添加到电极液(而不是细胞外溶液)中,以隔离电导或研究相关离子通道的活性。细胞贴附记录可用于研究依赖于可扩散第二信使活动的离子通道和/或高度“衰变”的通道。自发细胞放电活动可在电压或电流钳模式下记录,细胞通常保持在 0mV 或零电流水平,以无创方式测量电活动。
内面向外模式
在建立细胞贴附记录模式并实现稳定的千兆欧姆密封后,不是将牵制电压设置为负值以准备进行记录,而是设置钳制电位为 0mV。通过小心地将电极从细胞中拔出同时带出一小块细胞膜,形成细胞内面暴露在细胞浴液中的模式——由于电极玻璃和膜之间的封接形成非常牢固的结合,电极尖端内部的膜将被撕裂下来并留下完整的膜片(见图1)。如果电极的边缘的膜结合在一起形成囊泡,那就将电极提起进入空气中,这时细胞膜的“朝外”部分会因短暂暴露在空气中而被破坏。然而,如果细胞浴槽中灌注的是低浓度或无 Ca2+ 的溶液,则带出来的膜片不会形成囊泡。由于电极位于切除细胞膜的细胞外侧,并且假设钳制电位反映了贴片电极相对于地的电位,则钳制电位应为正值。内面向外记录模式中,细胞膜的细胞质表面暴露于浴液中;例如,这允许将受控浓度的细胞内信使添加到细胞浴液中,并对其影响进行研究。同样,配体可以添加到电极液(通常由细胞外溶液组成)中,并研究对细胞外离子通道结构域的影响。单通道记录也经常使用切除的内面向外膜片进行,特别是在研究细胞内信使的作用的情况下。为了便于形成内面向外记录模式,电极的阻抗通常略高于用于全细胞记录的阻抗。
全细胞模式
同样是在建立细胞贴附记录模式并实现稳定的千兆欧姆密封后,电极的钳制电位设置为静息膜电位(即−60至−70mV),为进入全细胞记录模式作准备。轻轻抽吸,使玻璃电极内产生负压吸破电极尖端下的细胞膜,使细胞内部与电极内部连通。此时电极内部与细胞内部的电路也相接通,测试脉冲电压将导致与 Cm 相关的缓慢瞬变电流。通常, Cm 约为 20–50pF(取决于细胞直径),通过慢电容补偿可以补偿该顺便电流。全细胞记录模式的形成也在电极的玻璃和细胞的脂质膜间引入了 Rs 。实际上,在全细胞记录模式中, Rs 与 Ra 同义,通常认为是一个小于 15–20MΩ 的值(取决于细胞的类型,并且可接受进一步的串联电阻补偿)。最终封接是否良好也可以通过将电压钳制在静息电位时的电流幅度(保持电流)来衡量,这是观察膜片钳是否维持在千兆欧封接的指标。理想情况下,在单细胞膜片钳实验中,良好条件下保持电流<10pA。那么现在就可以进行全细胞电压或电流钳记录。在整个实验过程中, 和 以及保持电流等参数应保持稳定。如果以上参数值在记录时发生了“漂移”,则应当停止记录。下面将进一步讨论不同情况下的全细胞记录。
穿孔全细胞记录模式
穿孔全细胞记录不像传统的全细胞记录那样使用抽吸来破坏膜片膜,而是通过使用制霉菌素、短杆菌肽或两性霉素B等造孔抗生素(将其加入电极液中)使电极和细胞之间的膜片穿孔,以连通电极和细胞内液。这同样需要首先将电极靠近细胞并快速形成千兆欧姆的封接。然后迅速对电极电容 Cp 进行快电容补偿。电极液中的穿孔抗生素会很快使膜片形成空隙,导致细胞内液和电极液连通,这时就可以监测到细胞膜电容 Cm 导致的瞬变电流,实验员就可以对其进行慢电容补偿;通常情况下, Ra 的值在 40–80MΩ 表示成功的“穿孔”。如果 Ra 的值过低,则有可能是膜完全破裂,形成传统的全细胞结构。穿孔全细胞记录模式通常允许单价离子在电极液和细胞内部之间通过,而第二信使分子被保留而不是从细胞质中“冲走”;因此,该模式是研究内源性细胞信号通路对离子通道调控的理想模式。穿孔全细胞记录模式通常更稳定,与传统的全细胞记录模式相比,它可以作为研究离子通道及其内源性细胞信号通路的首选方法。
外面向外模式
外面向外记录模式,在建立全细胞记录模式后,轻轻地将电极从细胞膜上“拔下”以破坏封接膜,然后可在电极尖端重新形成新的膜片,使外膜暴露于细胞浴液中(见图1)。在这种配置中,电极的阻抗通常略高于用于全细胞记录的阻抗。首先,这使得研究离子通道的数量比研究全细胞记录的数量要少。因此,可以研究单个通道的行为。在这里,可以控制电极内的细胞内液的成分以促进单通道记录或研究作用于细胞内离子通道域的试剂的作用。类似地,作用于细胞外离子通道域的试剂的作用可以通过将它们添加到细胞浴液或灌流液中来研究。这种模式还可以进行比全电池记录更大的电压控制;比如说,当一种离子通道分子在具有小电容的细胞膜中高度表达时,高“电流密度”可能会由于空间钳问题而妨碍全细胞记录。
以上就是我对膜片钳的基本基本原理及记录方法的简介,如果有批评建议或者有疑惑欢迎在下方的评论区留言。
参考文献
[4]Hille B (2001) Ion channels of excitable membranes. Sinauer, Sunderland, MA
